sábado, 8 de março de 2014
quarta-feira, 5 de março de 2014
Sabão Caseiro com Óleo de Cozinha Utilizado | Reação de Saponificação
Muitas vezes nos deparamos com a dificuldade da reciclagem do óleo de cozinha utilizado. Aqui você aprenderá um método fácil para o óleo ser reciclado, fazendo sabão!
Entenda o que é a Reação de Saponificação
Uma vez que óleos e gorduras são ésteres, eles sofrem reação de hidrólise ácida ou básica. A hidrólise ácida produzirá simplesmente o glicerol e os ácidos graxos constituintes. Já a hidrólise básica produzirá o glicerol e os sais desses ácidos graxos. Pois bem, esses sais são o que chamamos de sabão.O sabão já era conhecido, antes de Cristo, entre os fenícios e também entre os romanos. Porém, o entendimento do processo de saponificação em nível molecular é mais recente, como ilustra o texto em destaque. Assim, aquecendo gordura em presença de uma base, realizamos uma reação química que produz sabão. Essa reação, a hidrólise básica de um triéster de ácidos graxos e glicerol, é chamada de saponificação.
Óleo ou Gordura + Base → Glicerol + Sabão
O uso de KOH no lugar de NaOH permite obter sabões potássicos, empregados, por exemplo, na fabricação de cremes de barbear. Em muitas localidades do Brasil é comum, ainda hoje, encontrar pessoas que fazem o chamado sabão de cinza. Para fabricá-lo, deve-se ferver gordura animal (banha de vaca, por exemplo) ou vegetal (gordura de coco, por exemplo) junto com água de cinzas, também conhecida como lixívia. Após cerca de duas horas de fervura, está pronto o sabão de cinza. Esse processo é o mesmo usado em fábricas de sabão, sendo a cinza um substituto para o NaOH ou KOH. O caráter básico da água de cinza se deve à presença de carbonato de potássio (K2CO3), que reage com a água dando origem a íons OH
Como produzir o sabão
Ingredientes (Reagentes):
- 1L de óleo usado;
- 400mL de água;
- 120g de hidróxido de sódio em escamas (pode ser líquida, mas não produz o mesmo efeito);
- 100mL de vinagre;
- 20mL de essência aromatizante (facultativo);
- 1/2 copo de sabão em pó.
- Becheres de vidro de 2L e 1L de capacidade;
- Provetas de 200 e 100 mL de capacidade;
- Espátula, tela de amianto, vidro de relógio, bastão de vidro.
- Inicialmente, filtrar o óleo de cozinha a ser utilizado em um pano para retirar as partículas maiores;
- Dissolver o sabão em pó em 250mL de água
- Adicionar o hidróxido de sódio vagarosamente ao becher ontendo a água destilada. A operação de dissolução com o auxílio de um bastão de vidro deve ser gradativa, pois é muito exotérmica.
- Aqueça o óleo até ficar morno;
- Sob constante agitação, adicionar lentamente a solução de NaOH sobre o óleo;
- Após a completa adição da solução básica, adicionar ao meio reacional 100 mL de vinagre e homogeneizar completamente.;
- Transferir o material obtido para formas (aconselha-se caixas de leite);
- Deixar em repouso por pelo menos 48 horas (na metade do tempo corte-os, para que não fiquem muito duros).
Ácidos: Definição, Nomenclatura, Ionização e Fórmulas Estruturais
Definição (Arrhenius)
Ácidos são compostos que, em solução aquosa, liberam, exclusivamente como cátion, o íon hidrônio.Os hidrogênios contidos na molécula da substancia que, em solução, fornecem o H3O+, são chamados hidrogênios ionizáveis. Nos ácidos oxigenados o hidrogênio ionizável está ligado a oxigênio.

Nomenclatura

Hidrácidos (ácidos não-oxigenados)
Coloca-se a palavra ÁCIDO seguida do nome do elemento (ou radical) ligado hidrogênio, com terminação ÍDRICO.Ácido _______ídrico.
Exemplo:
HF Ácido Fluorídrico; HCl Ácido Clorídrico; HBr Ácido Bromídrico;
HI Ácido Iodídrico; H2S Ácido Sulfídrico; HCN Ácido Cianídrico.
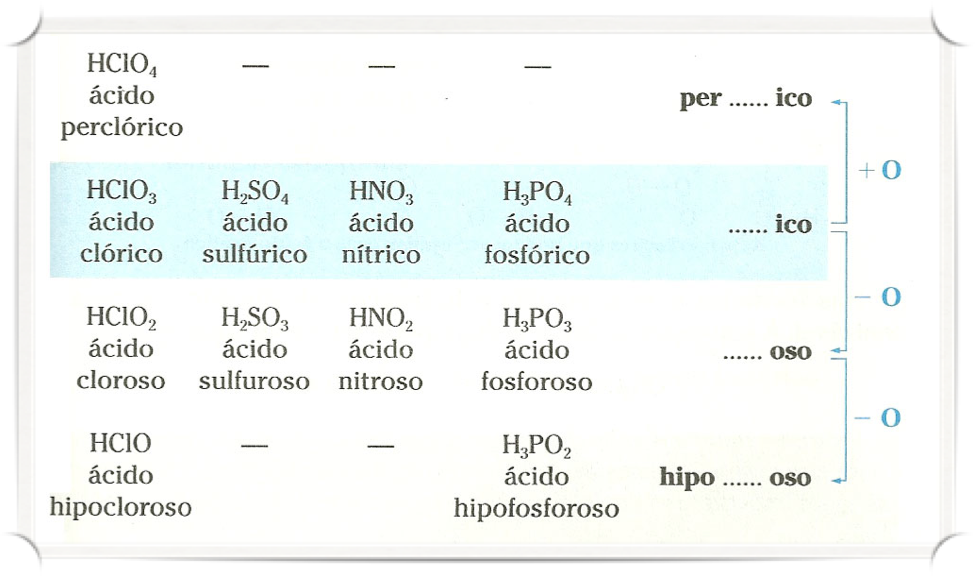
Oxoácidos (ácidos oxigenados)
Ácido _______ico.
Exemplo:
H3BO3 – Ácido Bórico; H2CO3 – Ácido Carbônico; HNO3 – Ácido Nítrico;
H3PO4 – Ácido Fosfórico; H2SO4 – Ácido Sulfúrico; HClO3 – Ácido Clórico.
Ácido _______oso.
Exemplo:
HNO2 – Ácido Nitroso; H3PO3 – Ácido Fosforoso; H2SO3 – Ácido Sulfuroso; HClO2 – Ácido Cloroso.
Ácido Hipo_______oso.
Exemplo:
H3PO2 – Ácido Hipofosforoso; HClO – Ácido Hipocloroso.
Ácido Per_______ico.
Exemplo:
HClO4 – Ácido Perclórico.
Exemplo:
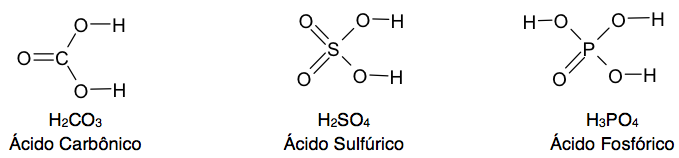
H3PO4 – Ácido Fosfórico ou Ácido Ortofosfórico;
Os ácidos resultantes de desidratações recebem o prefixo META ou PIRO, segundo as regras:

Fórmulas estruturais dos ácidos oxigenados
A regra para determinação das fórmulas estruturais consiste na seguinte sequência:- Escrever o símbolo do elemento que está no centro da fórmula molecular;
- Colocar um oxigênio entre cada hidrogênio e o elemento central;
- Ligar os oxigênios restantes, se houver, ao elemento central.
Ionização de ácidos
Ácidos são substâncias moleculares que, ao se dissolverem em água, sofrem ionização originando H+ como único íon positivo. O íon negativo que restar possuirá tantas cargas negativas quanto forem os H+ liberados.[1]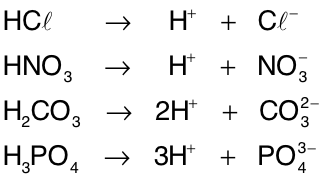
Os ácidos podem ser classificados de acordo com o número de hidrogênios ionizáveis que há em suas moléculas. Assim, HCl e HNO3 são monoácidos, H2CO3 e H2SO4 são diácidos, H3PO4 e H3BO3 são triácidose H4P2O7 é tetrácido.
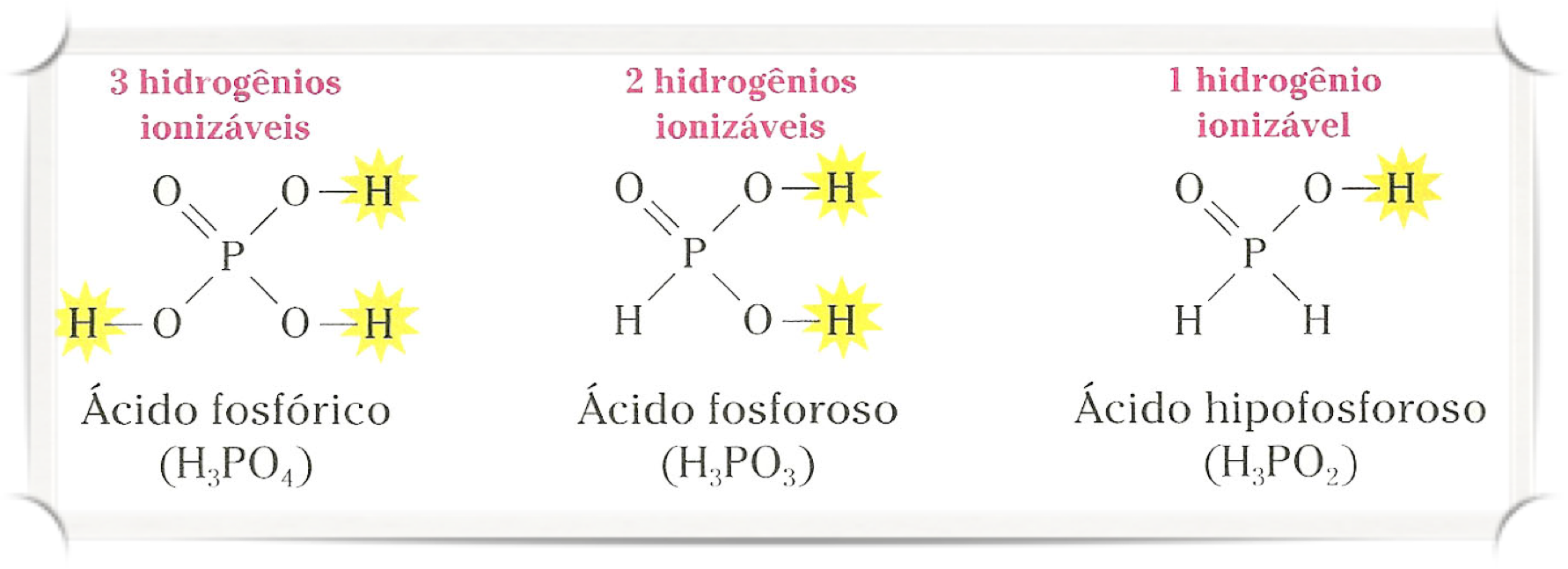
Ionização em etapas
Quando um ácido libera mais de um H+, na verdade ele o faz em etapas, liberando um por vez. Por exemplo:
O ácido fosforoso apresenta dois hidrogênios ionizáveis (diácidos), e o ácido hipofosforoso apenas um (monoácido).
Assinar:
Comentários (Atom)